La ley de Boyle es una de las distintas leyes de los gases que nos permite comprender cómo se comportan estos bajo distintas circunstancias. Si deseas conocer qué es la ley de Boyle, ejemplos prácticos, su fórmula y desarrollar ejercicios, continúa leyendo.
¿En qué consiste la ley de Boyle?
Como se acaba de mencionar, la ley de Boyle es una de las diversas leyes de los gases. Esta ley también es conocida como ley de Boyle – Mariotte, pues fue formulada por dos físicos en tiempos distintos y de manera independiente. El primero en formularla fue Robert Boyle en 1662, mientras que Edme Mariotte, sin conocer las investigaciones de Boyle también la formuló en 1676.
La ley de Boyle – Mariotte señala que a temperatura constante determinada cantidad de gas tendrá una relación inversamente proporcional entre su volumen y la presión que recibe. Es decir que: a mayor presión menor volumen o; a menor presión mayor volumen.
Ahora bien ¿Por qué si la presión ejercida sobre el gas es alta, el volumen de este disminuye? Imaginemos al gas como un montón de partículas contenidas en un recipiente con poca presión. Las partículas de gas estarían moviéndose con libertad en el interior del recipiente. Sin embargo, al someterse a una mayor presión, estas partículas se comprimirían, quedando juntas y con menos libertad para moverse.

Fórmula de la ley de Boyle
La ley de Boyle o ley de Mariotte puede expresarse matemáticamente mediante las siguientes fórmulas:
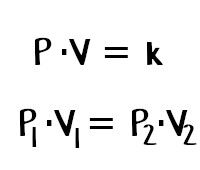
Cabe señalar que la ‘P’ representa la presión, la ‘V’ el volumen y la ‘k’ es la constante de la temperatura y la masa del gas. Respecto a la segunda fórmula, nos indica que el producto entre la presión y el volumen inicial es igual al producto de la presión y el volumen final. Si se despeja cualquiera de las incógnitas se obtienen las siguientes fórmulas:
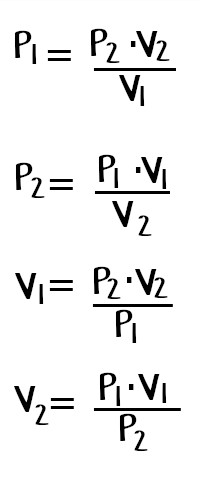
Ejemplos prácticos de la ley de Boyle – Mariotte
Para entender bien la ley de Boyle – Mariotte es útil buscar un contexto más práctico. Al practicar buceo, esta ley es de suma importancia para determinar la cantidad de oxígeno que necesitará un buceador durante su sumersión en el agua. Esto se debe a que al descender a una mayor profundidad, la presión aumenta tanto en nuestro cuerpo como en el equipo de buceo.
Es por ello que todas las partes de nuestro cuerpo en que haya aire, se comprimen, y por ende, nuestros pulmones también. Además, el oxígeno contenido en la botella de suministro de oxígeno también estará sometido a presión. Por lo tanto, este tendrá un menor volumen pero una mayor densidad. Para poder recibir un suministro eficiente en nuestros pulmones mientras buceamos necesitaremos mucho más oxígeno que en la superficie.

Cabe señalar también que la ley de Boyle es útil para comprender el síndrome de descompresión, también conocida como enfermedad del buzo. De hecho, esta enfermedad fue descrita por primera vez en 1670 por el mismo Robert Boyle. El físico y químico británico realizó un experimento con una víbora.
Al animal lo sometió a una presurización, y seguidamente a una descompresión. Luego la víbora falleció. Esto se debe a que al cuerpo tras someterse a una gran presión y posteriormente disminuirla, el nitrógeno en la sangre forma burbujas de aire. Dichas burbujas pueden pasar al torrente sanguíneo y ocasionar verdaderos problemas.
Por ello que es de suma importancia tomar las precauciones necesarias para evitar este problema, pues puede resultar fatal en los casos más graves.
En el siguiente archivo PDF encontrarás ejercicios de la ley de Boyle para que puedas comprender cómo se resuelven los problemas planteados con esta ley. Si deseas practicar, en este archivo PDF podrás desarrollar algunos ejercicios también.
